Curiosidades


Chuva Ácida


- Conceitos E Restrições De ácidos E Bases, Segundo Arrhenius, Brönsted E Lowry E Lewis
Os compostos estruturados pela Química Inorgânica são divididos, de maneira mais detalhada, em funções, são elas: ácidos, bases, sais, óxidos, hidretos e carbetos. No post de hoje, iremos descrever sobre os conceitos de ácidos e bases, segundo...
- Substâncias Químicas Perigosas: Classificação E Sinalização
O manuseio de substâncias químicas perigosas compreende o armazenamento, a manipulação e o transporte daquelas substâncias que apresentam riscos para a saúde das pessoas e perigos para as instalações nas plantas industriais. Esta seção contém...
- As Melhores Paródias De Química
Hoje com tantas opções de entretenimento para o aluno, é de fundamental importância que o professor saia do quadro e giz, e se aventure com seus alunos em meios mais lúdicos. O professor pode usufruir dos meios tecnológicos e da criatividade de...
- Por Que O Ovo Flutua Numa Solução De Sal? E Murcha Numa Solução De Açúcar?
Vamos analisar caso a caso das experiências abaixo:Olá querido leitor, hoje trouxe para você algumas experiências simples, que podem ser feitas em casa sem maiores dificuldades, porém com atenção aos acidentes; (Leia sobre Regras e Normas de Segurança...
- Por Que As Pessoas Choram Ao Descascar Cebola?
O que faz a gente chorar são os gases que a cebola libera na hora em que alguém passa a faca no vegetal. Em contato com a água dos olhos, eles reagem e formam um ácido que irrita o globo ocular. Aí, para se livrar do incômodo, o organismo...
Curiosidades
A IMPORTÂNCIA DO ÁCIDO SULFÚRICO PARA A INDÚSTRIA E A FORMAÇÃO DA CHUVA ÁCIDA

O ácido sulfúrico é o composto químico produzido e consumido mundialmente em maior quantidade. Virtualmente todos os ramos da indústria química dependem dele, direta ou indiretamente. Segundo o químico alemão, Justus Von Liebig, (1803-1873), a prosperidade comercial de uma nação pode ser medida pela quantidade de ácido sulfúrico que ela consome. O H2SO4 é um líquido viscoso, corrosivo e denso. O contato com a pele provoca queimadura e ulceração. Se ingerido, provoca erosão dental, queimaduras graves na boca e na garganta e possível perfuração do trato intestinal. Sua dissolução em água ocorre uma grande liberação de calor, o que pode provocar ebulição violenta e explosiva, espirrando solução quente e corrosiva na pessoa.

Grande parte dos produtos químicos industriais com os quais tomamos contato diário tem o ácido sulfúrico, H2SO4, envolvido, direta ou indiretamente, em fabricação: detergentes, plásticos, tintas, corantes, fibras têxteis, fertilizantes, baterias de automóveis etc. Trata-se do composto químico de maior importância para indústria, podendo seu consumo anual ser usado como indicador do grau de desenvolvimento da indústria química de um país.
Quando puro, apresenta-se como líquido incolor, oleoso, bastante denso (d=1,84 g/cm3) e de alto ponto de ebulição (338°C).
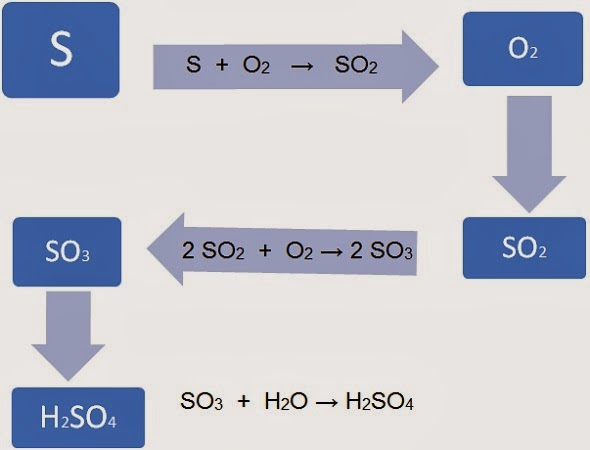
O mapa conceitual a seguir mostra, de forma esquemática, como o ácido sulfúrico é fabricado a partir das matérias-primas enxofre mineral, oxigênio do ar e água. O processo se é semelhante com o aparecimento de H2SO4 na chuva.

Quando o H2SO4 se dissolve em água, ocorre uma grande liberação de calor, que faz a temperatura da mistura aumentar.
O processo correto para misturar H2SO4 concentrado e água é adicionar lentamente o ácido sobre a água, nunca o contrário! Isso porque, ao jogar água sobre o ácido, a temperatura se eleva tanto que pode haver uma explosão (graças à fervura violenta da água), espirando ácido na pessoa e podendo até quebrar o recipiente que contém a solução. Esse tipo de cuidado deve ser tomado para qualquer ácido, não apenas para o H2SO4.
Observação:Ácidos concentrados são extremamente perigosos e NÃO devem ser manipulados por alunos.
O H2SO4é um ácido forte, bastante corrosivo, com ação desidratante; ou seja, ele é capaz de retirar água dos materiais. A adição de um pouco de H2SO4concentrado ao açúcar provoca a carbonização do açúcar, isto é, sua transformação em carvão. Assista ao vídeo, até o final, que mostra essa reação:
Chuva Ácida
A chuva é, naturalmente, um pouco ácida!

Plantas e animais, ao respirar, eliminam gás carbônico, CO2, na atmosfera. Podemos dizer que a presença desse gás na atmosfera é natural. Quando chove, ocorre uma reação entre ele e a água da chuva, produzindo ácido carbônico, que deixa a chuva ligeiramente ácida, já que se trata de um ácido fraco. A reação envolvida pode ser assim equacionada:
CO2 + H2O → H2CO3
A presença de H2CO3 na chuva ácida NÃO se deve necessariamente à poluição. Essa acidez natural da chuva é tão baixa que não faz nenhum mal aos seres vivos. A medida de pH de amostra de chuva em local não poluído revela um discreta acidez (pH = 5,6), que não é prejudicial ao meio ambiente.
Uma das principais impurezas que existem nos derivados de petróleo (gasolina, óleo diesel) e no carvão mineral são os compostos contendo o elemento enxofre (S). Quando esses combustíveis são utilizados, produz-se o dióxido de enxofre, um óxido ácido de cheiro bastante irritante.
S + O2 → SO2
Ao reagir com a água da chuva, o SO2 produz o ácido sulfúrico:
SO2 + H2O → H2SO4
Na atmosfera, parte do SO2 reage com o oxigênio e se transforma lentamente no SO3, outro óxido ácido. Embora essa reação seja difícil, ela é acelerada pela presença de certas partículas em suspensão na atmosfera. O SO3 formado reage com a água da chuva, produzindo H2SO4, que é um ácido forte.
2 SO2 + O2 → 2 SO3
SO3 + H2O → H2SO4
Assim se origina a chamada chuva ácida, ou seja, chuva com acidez superior àquela naturalmente devida ao CO2. Ela é responsável por inúmeros problemas, entre os quais se destacam:

- Prejuízos para a agricultura, pois o solo se torna ácido e, ao mesmo tempo, o SO2 destrói as folhas dos vegetais;
- A água dos rios e lagos se torna ácida e, consequentemente, imprópria à vida de peixes;
- Corrosão do mármore, do ferro e de outros materiais usados em monumentos e construções.
Observação:o álcool proveniente da cana-de-açúcar não contém compostos de enxofre e, portanto, não contribui para o aparecimento de H2SO4 na chuva.
loading...
- Conceitos E Restrições De ácidos E Bases, Segundo Arrhenius, Brönsted E Lowry E Lewis
Os compostos estruturados pela Química Inorgânica são divididos, de maneira mais detalhada, em funções, são elas: ácidos, bases, sais, óxidos, hidretos e carbetos. No post de hoje, iremos descrever sobre os conceitos de ácidos e bases, segundo...
- Substâncias Químicas Perigosas: Classificação E Sinalização
O manuseio de substâncias químicas perigosas compreende o armazenamento, a manipulação e o transporte daquelas substâncias que apresentam riscos para a saúde das pessoas e perigos para as instalações nas plantas industriais. Esta seção contém...
- As Melhores Paródias De Química
Hoje com tantas opções de entretenimento para o aluno, é de fundamental importância que o professor saia do quadro e giz, e se aventure com seus alunos em meios mais lúdicos. O professor pode usufruir dos meios tecnológicos e da criatividade de...
- Por Que O Ovo Flutua Numa Solução De Sal? E Murcha Numa Solução De Açúcar?
Vamos analisar caso a caso das experiências abaixo:Olá querido leitor, hoje trouxe para você algumas experiências simples, que podem ser feitas em casa sem maiores dificuldades, porém com atenção aos acidentes; (Leia sobre Regras e Normas de Segurança...
- Por Que As Pessoas Choram Ao Descascar Cebola?
O que faz a gente chorar são os gases que a cebola libera na hora em que alguém passa a faca no vegetal. Em contato com a água dos olhos, eles reagem e formam um ácido que irrita o globo ocular. Aí, para se livrar do incômodo, o organismo...
