Curiosidades





- É Verdade Que é Fisicamente Impossível Encostar Em Algo?
Os átomos, que compõem toda a matéria conhecida do universo, são formados por algumas partículas ainda menores, como os prótons, nêutrons (estes ainda compostos por quarks) e elétrons. Mas o que mais existe dentro de um átomo é um enorme...
- Paramagnétismo | Diamagnetismo | Ferromagnetismo
Configuração eletrônica e magnetismo – Há 3 propriedades aos átomos e moléculas em geral que envolvem campos magnéticos e só dependem da configuração deles, são elas:Paramagnetismo – é a propriedade que certos átomos ou moléculas possuem...
- Os Elementos QuÍmicos Mais Abundantes No Corpo Humano, Na Terra E No Universo
Denomina-se elemento químico um conjunto de átomos que têm o mesmo número de prótons em seu núcleo, ou seja, o mesmo número atômico (Z). Todos os elementos possuem massa atômica, número atômico, ponto de fusão e ebulição....
- Radioatividade: Radiações Alfa, Beta E Gama
Denomina-se radioatividade a atividade que certos átomos possuem de emitir radiações eletromagnéticas e partículas de seus núcleos instáveis com o propósito de adquirir estabilidade. A emissão de partículas do núcleo faz com que o átomo...
- Todo Sistema Homogêneo é Uma Mistura Homogênea? E Todo Sistema Heterogêneo é Uma Mistura Heterogênea?
Uma dúvida (confusão) que pode ser feita quando se estuda os tipos de misturas são os conceitos dos seguintes termos: sistema homogêneo e mistura homogênea; sistema heterogêneo e mistura heterogênea. Vou exemplificar para você entender melhor:...
Curiosidades
A Identificação dos Átomos: Isótopos, Isóbaros, Isótonos e Isoeletrônicos

Talvez você, amigo leitor, ainda não tenha percebido, mas os números estão presente em quase tudo. Eles estão sempre representando algo ou alguma coisa. As pessoas são identificadas por RG, CPF, etc; podemos observar a presença dos números nas placas dos carros, na identificação do seu computador, celular, nos tamanhos dos calçados e roupas; nas medições da construção civil, do tempo, e etc.
Em algumas situações do nosso cotidiano certamente estamos usando os números.
Não sendo diferente para muitos dos assuntos na química. Como você sabe o átomo, que muiiiito pequeno, é formado por outras coisinhas ainda menores chamadas de partículas. As três partículas que compõe o átomo são os prótons, nêutrons e os elétrons. Pra você compreender e se inteirar mais sobe o assunto, vejamos alguns conceitos importantes:
Não sendo diferente para muitos dos assuntos na química. Como você sabe o átomo, que muiiiito pequeno, é formado por outras coisinhas ainda menores chamadas de partículas. As três partículas que compõe o átomo são os prótons, nêutrons e os elétrons. Pra você compreender e se inteirar mais sobe o assunto, vejamos alguns conceitos importantes:
O que é átomo?
Átomoé a menor unidade da matéria constituída de prótons, nêutrons e elétrons.
Por conversão (escolha padrão), os prótons têm carga positiva (+), os elétrons têm carga negativa (-) e os nêutrons têm carga nula (sem carga).
Observação: não confunda átomos com elementos químicos; até então temos apenas 112 elementos químicos diferentes reconhecidos pela IUPAC (sigla em inglês que significa União Internacional de Química Pura e Aplicada), que são aqueles elementos vistos na Tabela Periódica, definidos como sendo um conjunto de átomos com o mesmo número de atômico. Agora, cada elemento químico tem uma quantidade infinita de átomos espalhadas pelo mundo.
Sendo assim, o que diferencia um elemento químico do outro?
O que diferencia um elemento do outro é a quantidade da partícula próton em cada átomo. Por exemplo, o elemento oxigênio (O) tem 8 prótons em seu núcleo, e mais nenhum outro elemento químico apresenta esta mesma quantidade. Ou seja, cada um dos 112 elementos possui uma quantidade de próton específica, e é isto que caracteriza o oxigênio ser o oxigênio. Observe a Tabela Periódica.
Leia também:
@ Consumo Consciente. Você Pratica?;
@ A Política dos 3 Rs: Reduzir, Reutilizar e Reciclar;
@ Investigadores da Química: De onde vem a Química?;
@ O gás de cozinha não exala nenhum cheiro. É verdade?;
@ O que significar dizer que o Protetor Solar tem um Fator de Proteção 15, 30, etc?;
Se você entendeu bem, deve estar se perguntando: e as quantidades de elétrons e nêutrons podem se repetir em mais de um elemento químico? A resposta é sim. Para esclarecer mais, temos:
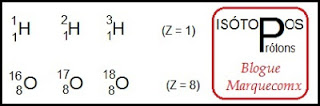
Número Atômico (Z) é o número de prótons existentes no núcleo de um átomo.
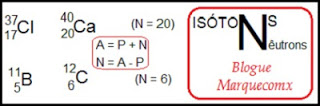
Número de Massa (A) é a soma de todos as partículas que compõe o átomo, só que como a massa dos elétrons é tãooo leve que sua massa é desprezada; assim somamos apenas o número de prótons (P=Z) e de nêutrons (N) existentes num átomo.

Elemento Químico é o conjunto de átomos com o mesmo número atômico (Z); sua representação é feita por símbolos como o cloro, por exemplo:

Observação importante: você já sabe que não existem dois elementos químicos diferentes com o mesmo número de prótons. Porém elementos diferentes podem apresentar quantidades de nêutrons e elétrons iguais.
Dependendo da diferença entre as quantidades das partículas próton, elétron e nêutron podem classificar os átomos em Isótopos, Isóbaros, Isótonos e Isoeletrônicos (iso = igual).
Isótopossão átomos com mesmo número de prótons (z) e diferente número de massa (A). Isto acontece a quase todos os elementos químicos naturais, devido a um fenômeno muito comum na natureza chamado de isotropia. Observe que é o mesmo elemento químico:

Isóbarossão átomos de diferentes números de prótons (elementos diferentes), mas que possuem o mesmo número de massa (A). Exemplos:

Isótonossão átomos de diferentes números de prótons (elementos diferentes), diferentes números de massa, porém com mesmo número de nêutrons (N). Exemplos:

Isoeletrônicosão átomos que apresentam mesmo número de elétrons. Exemplo:

Aqui caberia escrever sobre átomos no estado fundamental e átomo no estado ativado (cátion e ânion), porém farei isto noutro texto.
Gostou do texto? Espero ter ajudado em seu aprendizado. Contribua! Dê sua opinião sobre o estudo da Química, deixe um comentário! Leia sobres as Propriedades da Matéria.
loading...
- É Verdade Que é Fisicamente Impossível Encostar Em Algo?
Os átomos, que compõem toda a matéria conhecida do universo, são formados por algumas partículas ainda menores, como os prótons, nêutrons (estes ainda compostos por quarks) e elétrons. Mas o que mais existe dentro de um átomo é um enorme...
- Paramagnétismo | Diamagnetismo | Ferromagnetismo
Configuração eletrônica e magnetismo – Há 3 propriedades aos átomos e moléculas em geral que envolvem campos magnéticos e só dependem da configuração deles, são elas:Paramagnetismo – é a propriedade que certos átomos ou moléculas possuem...
- Os Elementos QuÍmicos Mais Abundantes No Corpo Humano, Na Terra E No Universo
Denomina-se elemento químico um conjunto de átomos que têm o mesmo número de prótons em seu núcleo, ou seja, o mesmo número atômico (Z). Todos os elementos possuem massa atômica, número atômico, ponto de fusão e ebulição....
- Radioatividade: Radiações Alfa, Beta E Gama
Denomina-se radioatividade a atividade que certos átomos possuem de emitir radiações eletromagnéticas e partículas de seus núcleos instáveis com o propósito de adquirir estabilidade. A emissão de partículas do núcleo faz com que o átomo...
- Todo Sistema Homogêneo é Uma Mistura Homogênea? E Todo Sistema Heterogêneo é Uma Mistura Heterogênea?
Uma dúvida (confusão) que pode ser feita quando se estuda os tipos de misturas são os conceitos dos seguintes termos: sistema homogêneo e mistura homogênea; sistema heterogêneo e mistura heterogênea. Vou exemplificar para você entender melhor:...
